гҖҠ з”ҹзү©зү©зҗҶжүҖз ”з©¶еҸ‘зҺ°иӮҝзҳӨиЎҖз®Ўз”ҹжҲҗж–°жңәеҲ¶ & a; I- T, W! r9 Q& z+ B4 o2 S
еҗҢж—¶жҸҗеҮәиӮҝзҳӨжІ»з–—иҒ”еҗҲз»ҷиҚҜзӯ–з•Ҙ гҖӢ& P* P+ J, Q9 f5 e6 p+ U
: i+ s3 ?* X `! i0 B3 t8 ]; i! y' a) z F
6жңҲ20ж—ҘпјҢBLOODжқӮеҝ—еңЁзәҝеҸ‘иЎЁдәҶдёӯеӣҪ科еӯҰйҷўз”ҹзү©зү©зҗҶз ”з©¶жүҖйҳҺй”Ўи•ҙиҜҫйўҳз»„еңЁиӮҝзҳӨиЎҖз®Ўз”ҹжҲҗж–№йқўзҡ„жңҖж–°з ”з©¶жҲҗжһңгҖӮиҝҷжҳҜиҜҘиҜҫйўҳ组继еҸ‘зҺ°CD146жҳҜиӮҝзҳӨиЎҖз®Ўж–°йқ¶ж Үд№ӢеҗҺзҡ„еҸҲдёҖйҮҚеӨ§зӘҒз ҙгҖӮ
" M; w9 S$ k, X6 n- r6 ~! E3 L" H# ~ ^5 l. E) a7 W J2 Q3 K9 D
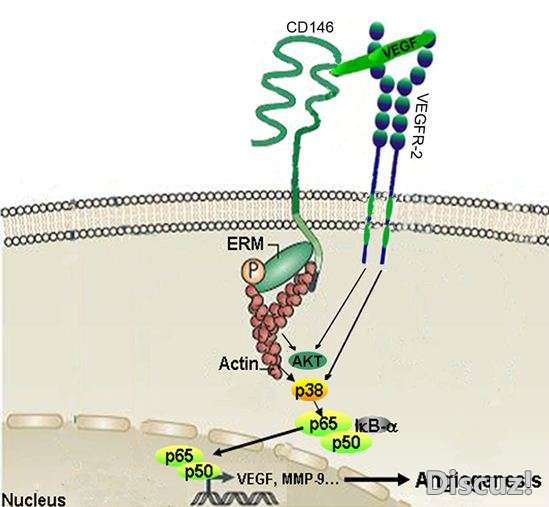
жӯӨйЎ№з ”з©¶жҸӯзӨәдәҶиӮҝзҳӨиЎҖз®ЎеҶ…зҡ®ж Үеҝ—еҲҶеӯҗCD146дҪңдёәз»ҶиғһиЎЁйқўеҸ—дҪ“дҝғиҝӣиЎҖз®Ўз”ҹжҲҗзҡ„жңҖж–°еҲҶеӯҗжңәеҲ¶пјҢжҳҜCD146дҪңдёәиӮҝзҳӨиЎҖз®Ўз”ҹжҲҗж Үеҝ—еҲҶеӯҗзҡ„жңҖзӣҙжҺҘиҜҒжҚ®гҖӮиҝҷдёҖеҸ‘зҺ°жңҖйҮҚиҰҒзҡ„ж„Ҹд№үжҳҜе…¶жҸҗдҫӣдәҶдёҖз§ҚжӣҙеҠ жңүж•Ҳзҡ„жІ»з–—иӮҝзҳӨзҡ„ж–°зӯ–з•ҘпјҢеҚійқ¶еҗ‘CD146дҪңдёәVEGFR-2е…ұеҸ—дҪ“иҝҷдёҖи§’иүІиҝӣиЎҢжҠ—дҪ“иҒ”еҗҲжІ»з–—гҖӮ : q! |& f2 x: b+ q
: n l2 v$ w J( y. m
иЎҖз®ЎеҶ…зҡ®з»Ҷиғһз”ҹй•ҝVEGFжҳҜиӮҝзҳӨиЎҖз®Ўз”ҹжҲҗиҝҮзЁӢдёӯжңҖйҮҚиҰҒзҡ„и°ғжҺ§еӣ еӯҗпјҢеӣ жӯӨпјҢйқ¶еҗ‘VEGFжІ»з–—е·Із»ҸжҲҗдёәйқ¶еҗ‘иӮҝзҳӨиЎҖз®ЎжІ»з–—зҡ„зғӯзӮ№пјҢе…¶дёӯжңҖжңүж•Ҳзҡ„жҠ—дҪ“иҚҜзү©жҳҜиҙқдјҗеҚ•жҠ—(Bevacizumab)пјҢеҚіжҠ—VEGFзҡ„еҚ•е…ӢйҡҶжҠ—дҪ“пјҢе®ғйҖҡиҝҮйҳ»ж–ӯVEGFдёҺе…¶еҸ—дҪ“VEGFR-2зҡ„з»“еҗҲпјҢйҳ»ж–ӯVEGFеј•иө·зҡ„еҶ…зҡ®з»Ҷиғһжҙ»еҢ–е’ҢиЎҖз®Ўз”ҹжҲҗпјҢд»ҺиҖҢжҠ‘еҲ¶иӮҝзҳӨз”ҹй•ҝгҖӮиҮӘ2004е№ҙдҪңдёә第дёҖдёӘжңүж•ҲжҠ‘еҲ¶иӮҝзҳӨиЎҖз®Ўз”ҹжҲҗзҡ„жҠ—дҪ“иҚҜзү©иў«зҫҺеӣҪFDAжү№еҮҶдёҠеёӮеҗҺпјҢиҙқдјҗеҚ•жҠ—е·Із»Ҹиў«жү№еҮҶеә”з”ЁдәҺжІ»з–—з»“зӣҙиӮ зҷҢгҖҒд№іи…әзҷҢгҖҒйқһе°Ҹз»ҶиғһиӮәзҷҢгҖҒиӮҫзҷҢзӯүзҷҢз—ҮпјҢе№ҙдә§еҖјзәҰдёә60дәҝзҫҺе…ғгҖӮ
( J; _3 q" o0 b1 |9 N
- }2 N. ?, h2 P4 T" v1 IйҳҺй”Ўи•ҙиҜҫйўҳз»„з ”з©¶еҸ‘зҺ°пјҢCD146жҳҜиЎҖз®ЎеҶ…зҡ®з»Ҷиғһз”ҹй•ҝеӣ еӯҗеҸ—дҪ“VEGFR-2зҡ„е…ұеҸ—дҪ“пјҢи°ғиҠӮVEGFиҜұеҜјзҡ„VEGFR-2зҡ„жҙ»еҢ–еҸҠдёӢжёёдҝЎеҸ·зҡ„дј йҖ’пјҢиҝӣиҖҢдҝғиҝӣиӮҝзҳӨиЎҖз®Ўз”ҹжҲҗгҖӮеҹәдәҺCD146жҳҜVEGFR-2е…ұеҸ—дҪ“иҝҷдёҖеҲҶеӯҗжңәеҲ¶пјҢз ”з©¶дәәе‘ҳеҲ©з”ЁжҠ—CD146еҚ•е…ӢйҡҶжҠ—дҪ“AA98еҸҠжҠ—VEGFеҚ•е…ӢйҡҶжҠ—дҪ“BevacizumabпјҢе»әз«ӢдәҶйқ¶еҗ‘иЎҖз®Ўз”ҹжҲҗзҡ„жҠ—дҪ“иҒ”еҗҲжІ»з–—жЁЎеһӢпјҢиҜҘиҒ”еҗҲзӯ–з•Ҙзҡ„жңүж•ҲжҖ§еңЁжҺҘз§Қдәәиғ°и…әзҷҢз»Ҷиғһе’Ңдәәй»‘зҙ зҳӨз»Ҷиғһзҡ„иЈёйј иҚ·зҳӨжЁЎеһӢдёӯеҫ—еҲ°йӘҢиҜҒпјҢеҚідёҺеҚ•дёҖжҠ—дҪ“з»ҷиҚҜзӣёжҜ”пјҢAA98еҸҠBevacizumabиҒ”еҗҲз»ҷиҚҜе…·жңүеҚҸеҗҢж•Ҳеә”пјҢе…¶жҠ‘зҳӨзҺҮжҳҜBevacizumabеҚ•зӢ¬з»ҷиҚҜз»„1.5еҖҚгҖӮ9 }; y3 Y4 I$ a. }& m
$ @+ O, A" y. _" c1 X2 N
дёҠиҝ°з ”究жҲҗжһңдёҚд»…жҸӯзӨәдәҶCD146дҪңдёәеҶ…зҡ®з»ҶиғһеҸ—дҪ“дҝғиҝӣиӮҝзҳӨиЎҖз®Ўз”ҹжҲҗзҡ„ж–°жңәеҲ¶пјҢеҗҢж—¶д№ҹдёәдёҙеәҠйқ¶еҗ‘иЎҖз®Ўж–°з”ҹжІ»з–—иӮҝзҳӨжҸҗдҫӣдәҶж–°жҖқи·Ҝе’Ңж–°зӯ–з•ҘпјҢиҝҷз§ҚиҒ”еҗҲжІ»з–—зӯ–з•Ҙзҡ„й«ҳж•ҲжҖ§дёәжӣҙеӨҡзҷҢз—ҮжӮЈиҖ…еёҰжқҘдәҶжӣҷе…үгҖӮ , g' q0 G$ }# T& o: O
+ j k) z f% P- M# |( D+ i2 ZиҜҘйЎ№з ”з©¶еҫ—еҲ°з§‘жҠҖйғЁгҖҒиҮӘ然科еӯҰеҹәйҮ‘委е’ҢдёӯеӣҪ科еӯҰйҷўзҡ„иө„еҠ©гҖӮ
! ~/ M8 |& \ g1 S3 @8 {/ u+ [
|